Johdanto
Tekstissä lyhenne AA viittaa Ascorbic Acidiin eli askorbiinihappoon, joka tarkoittaa C-vitamiinia.
C-vitamiini on tärkeä antioksidantti ja kofaktori, joka osallistuu useiden solutyyppien kehityksen, toiminnan ja ylläpidon säätelyyn elimistössä. C-vitamiinin puutokset voivat johtaa sairauksiin, kuten keripukkiin, joka aiheuttaa muun muassa ientulehduksia, luukipua ja heikentynyttä haavan paranemista. Tässä katsauksessa tarkastellaan C-vitamiinin toiminnallista merkitystä erityisesti luukudosten kehityksen ja ylläpidon näkökulmasta. Useiden epidemiologisten tutkimusten ja geneettisten hiirimallien analyysi osoittaa C-vitamiinilla olevan positiivinen vaikutus luuston terveyteen. Kaiken kaikkiaan C-vitamiini vaikuttaa positiivisesti hohkaluun muodostumiseen säätelemällä luun matriisigeenien ilmentymistä osteoblasteissa.
Historiallinen näkökulma
C-vitamiinin puutos voi aiheuttaa monenlaisia sairauksia, jotka on dokumentoitu jo 1500 eKr. egyptiläisen lääkekasvitietäjän Ebersin papyruksessa. Keripukki, AA-puutoksen aiheuttama häiriö, voi aiheuttaa monia komplikaatioita, kuten väsymystä, luukipua, ientulehdusta, heikentynyttä haavan paranemista, lihaskipua, heikentynyttä luun kasvua ja näennäishalvausta. 1700-luvulla tohtori James Lind, merivoimien lääkäri, havaitsi, että keripukkia voitiin hoitaa sitrushedelmien (esim. sitruunat ja appelsiinit) nauttimisella, mikä vähensi oireita.
C-vitamiinin rooli ei-luustokudoksissa
C-vitamiini vaikuttaa useisiin kudoksiin globaalin toimintansa ansiosta tärkeänä kollageenisynteesin komponenttina ja antioksidanttina. AA osallistuu kollageenin synteesiin vaikuttamalla prolyylihydroksylaasialueen proteiinin (PHD) toimintaan, joka hydroksyloi proliineja, jotka ovat tärkeitä kollageenin kokoonpanossa. C-vitamiini on mukana verisuonten uudelleenmuokkauksessa sekä verisuonisoluja ylläpitävässä toiminnassa vaikuttamalla verisuonten sileiden lihassolujen erilaistumiseen ja sidekudosproteiinien ilmentymiseen.
Poikittaistutkimusten laajan menetelmällisen vaihtelun vuoksi tulosten vertailu on vaikeaa, ja havainnot ovat olleet epäjohdonmukaisia. Esimerkiksi useat tutkimukset ovat tarkastelleet ravitsemuksellisen C-vitamiinin saannin ja BMD:n välistä yhteyttä postmenopausaalisilla naisilla käyttämällä monimuuttujaisia lineaarisia regressiomalleja. Me(16) ja muut(17,23,33) havaitsimme merkittäviä positiivisia korrelaatioita ravitsemuksellisen C-vitamiinin ja BMD:n välillä yhdessä tai useammassa luustokohteessa. Sen sijaan muut tutkimukset(18,19,22,25) raportoivat positiivisia yhteyksiä C-vitamiinin ja BMD:n välillä, mutta vaikutuskoot olivat pienempiä eivätkä merkittäviä. Eräs tutkimus raportoi negatiivisia, ei-merkittäviä korrelaatioita(28). Vastaavia epäjohdonmukaisuuksia esiintyy myös vertaillessa poikittaistutkimuksia, joissa mitattiin muita C-vitamiinin altistuksen muuttujia (esim. lisäravinteen ja kokonaisvaltaisen C-vitamiinin saanti tai C-vitamiinin veripitoisuudet), tutkittiin miesväestöä ja tehtiin erilaisia kovariaattianalyyseja. Kuten edellä, useimmat tutkimukset raportoivat positiivisia suuntauksia, mutta vaikutuskoko ja tilastollinen merkitsevyys vaihtelivat.
Tapaus-verrokkitutkimusasetelmaa on käytetty viidessä tutkimuksessa. Kolme näistä määritti tapauksen murtuman perusteella (lonkka(26,34) tai mikä tahansa haurausmurtuma(35) ja mittasi veren AA-tasoja. Falch ym.(34) ja Martinez-Ramirez ym.(35) tutkivat sekä ikääntyneitä miehiä että naisia ja raportoivat, että seerumin C-vitamiinitasot olivat merkitsevästi korkeammat verrokeilla verrattuna lonkkamurtuman tai haurausmurtuman kokeneisiin. Toisaalta Lumbers ym.(26) tutki vain ikääntyneitä naisia ja havaitsi päinvastaisen ilmiön: C-vitamiinipitoisuudet plasmassa olivat korkeampia lonkkamurtumatapauksissa kuin verrokeilla. Kaksi muuta tapaus-verrokkitutkimusta tunnisti osteoporoositapaukset (T-pisteet ≤ −3,5(36) tai ≤ −2,5(37)). Toisessa tutkimuksessa arvioitiin plasman AA-tasoja(36) ja toisessa ravitsemuksellinen C-vitamiinin saanti FFQ:n avulla(37). Molemmat tutkimukset koskivat iäkkäitä naisia ja molemmat osoittivat, että osteoporoosipotilailla oli alhaisempi C-vitamiinipitoisuus kuin verrokeilla.
Kolme pitkittäistutkimusta on arvioinut C-vitamiinia ja luuston terveyttä ikääntyneillä(27,31,32). Sahnin ja kollegoiden suorittama tutkimus käytti Yhdysvaltain Framingham-tutkimuksen kardiotulostutkimuksesta saatuja tietoja(38), keskittyi murtumien esiintyvyyteen luuston tuloksena ja sisälsi pitkän seurantajakson (15–17 vuotta)(27). Tässä Framinghamin alitutkimuksessa tutkittiin Yhdysvaltain miehiä ja naisia ((N=918; keski-ikä ∼75 vuotta) ja arvioitiin C-vitamiinin kulutuksen (ravinto, lisäravinne ja kokonaisvaltainen) ja murtumariskin välisiä yhteyksiä FFQ-menetelmällä mitattuna. Kokonaisvaltaisen C-vitamiinin saannin ja lisäravinteiden käytön välillä havaittiin merkitseviä, käänteisiä annos-riippuvaisia suuntauksia murtumariskin suhteen. Lääketieteellisiin asiakirjoihin perustuvien lonkka- ja itse ilmoitettujen muiden kuin nikamamurtumien hazardisuhteet olivat merkittävästi pienempiä korkeimmassa kokonais-C-vitamiinin saantitertiilissä (keskiarvoinen kokonais-C-vitamiinin saanti = ∼300 mg/päivä) verrattuna alimpaan tertiiliin (keskiarvoinen kokonais-C-vitamiinin saanti = ∼95 mg/päivä). Samoin lonkkamurtuman riski oli merkittävästi pienempi C-vitamiinilisää käyttävillä (keskimääräinen 260 mg/päivä) verrattuna lisäravinnetta käyttämättömiin. Ei-merkittäviä suuntauksia, jotka viittaavat suojaaviin vaikutuksiin, havaittiin myös korkeamman C-vitamiinilisän käytön ja muiden kuin nikamamurtumien sekä ravitsemuksellisen saannin ja lonkan ja muiden kuin nikamamurtumien välillä.
Sahnin ym. suorittama toinen pitkittäistutkimus käytti Framinghamin tietoja ja tutki neljän vuoden BMD-muutoksia eri kohteissa ensisijaisena tuloksena ja raportoi vaihtelevia tuloksia iäkkäillä aikuisilla (N=606)(31). Merkittäviä yhteyksiä ei havaittu naisilla. Miehillä havaittiin hyödyllisiä vaikutuksia joissakin, mutta ei kaikissa C-vitamiinin saantimuuttujissa, joissakin, mutta ei kaikissa tutkituissa luukohteissa. Tulokset vaihtelivat myös kalsiumin saannin mukaan jaetussa miesryhmässä. Kolmas pitkittäistutkimus, joka tehtiin myös iäkkäillä miehillä ja naisilla (N=944; keski-ikä ∼72 vuotta), arvioi C-vitamiinin ravitsemuksellista saantia 7 päivän ruokapäiväkirjan avulla ja tarkasteli luukatoa kahden BMD-mittauksen välillä kokonaislonkassa, jotka otettiin 2–5 vuoden välein(32). Tulokset viittasivat C-vitamiinin hyödyllisiin vaikutuksiin naisilla, sillä C-vitamiinilla oli merkitsevästi yhteys nopeampaan luukatoon lineaarisessa suhteessa C-vitamiinin saannin tertiilien kasvaessa. Miehillä havaittiin samankaltainen lineaarinen suuntaus, mutta vaikutus oli pienempi eikä merkittävä.
Tähän mennessä ei ole tehty satunnaistettuja, lumekontrolloituja kliinisiä kokeita (RTCs), joissa arvioitaisiin yksinomaan C-vitamiinin altistuksen vaikutusta luustoon. Kaksi pientä (N=30 tai N=7–11 per ryhmä), satunnaistettua lumekontrolloitua tutkimusta on kuitenkin tehty, jotka tarkastelevat BMD:n muutosta ja C- ja E-vitamiinin yhdistelmäannosten käyttöä(29,30). Molemmissa tutkimuksissa raportoitiin merkittäviä suojaavia luuvaikutuksia joissakin luustokohteissa, mutta ei kaikissa. Kolmannessa pienessä (N=13) interventiotutkimuksessa, jossa käytettiin ennen-jälkeen-tutkimusasetelmaa, havaittiin luukohtaisen alkalisen fosfataasin väheneminen, kun koehenkilöt saivat päivittäin C- ja E-vitamiinia 8 viikon ajan(39).
Ottaen huomioon moninaiset menetelmät, joita on käytetty kliinisten C-vitamiinin vaikutusten tutkimisessa luustossa, ei ole yllättävää, että raportoiduissa tuloksissa esiintyy epäjohdonmukaisuuksia.
Kokonaisuudessaan tarkasteltuna suurin osa tutkimuksista on kuitenkin havainnut joko merkittäviä hyödyllisiä vaikutuksia C-vitamiinilla tai positiivisia, mutta ei-merkitseviä vaikutuksia yhdessä tai useammassa luustotuloksessa. Lisäksi eri kovariaattianalyysien perusteella havaittavat erot viittaavat siihen, että C-vitamiinin vaikutukset ovat todennäköisesti muiden tekijöiden vaikutuksessa. Lopuksi nämä havainnot viittaavat siihen, että C-vitamiinin vaikutukset luustoon ovat luonteeltaan hyödyllisiä, mutta erittäin monimutkaisia.
C-vitamiinin biosynteesi ja eläinmallit C-vitamiinin puutoksista ja niiden vaikutuksista luustoon
Suurin osa eläimistä, mukaan lukien rotat ja hiiret, kykenee tuottamaan C-vitamiinia de novo -synteesillä. Näissä lajeissa C-vitamiinin tuotanto alkaa UDP-glukoosin muodostumisella D-glukoosi-1-fosfaatista ja uridiinitrifosfaatista (UTP). UDP-glukoosi dehydrogenoituu ja menettää uridiinidifosfaattinsa, jolloin se muuttuu D-glukuronaatiksi (Kuva 1). Seuraavaksi D-glukuronaatti pelkistyy L-gulonaatiksi, jota voidaan käyttää joko C-vitamiinin synteesireitissä tai pentoosifosfaattireitissä. C-vitamiinin biosynteesissä L-gulonaatti muutetaan entsymaattisesti L-gulono-γ-laktoniksi gulonolaktonaasin avulla. Senescence marker protein 30 (SMP30) -proteiinissa oleva mutaatio, joka toimii gulonolaktonaasina, estää L-gulonaatin muuttumisen L-gulono-γ-laktoniksi. Tällaisilla mutaatiolla varustettuja hiiriä käytetään usein C-vitamiinin puutostutkimuksissa. Synteesireitin viimeisessä vaiheessa L-gulono-γ-laktoni muuttuu askorbiinihapoksi (AA) L-gulonolaktonioksidaasin (GULO) avulla. Vaikka monet nisäkkäät tuottavat C-vitamiinia de novo, tämä kyky on evoluution myötä hävinnyt joillakin lajeilla, kuten marsuilla, kapibaroilla, tietyillä lepakoilla ja joillakin kädellisillä, mukaan lukien ihmiset(40,41).
Kuva: cvit-bone1.jpg
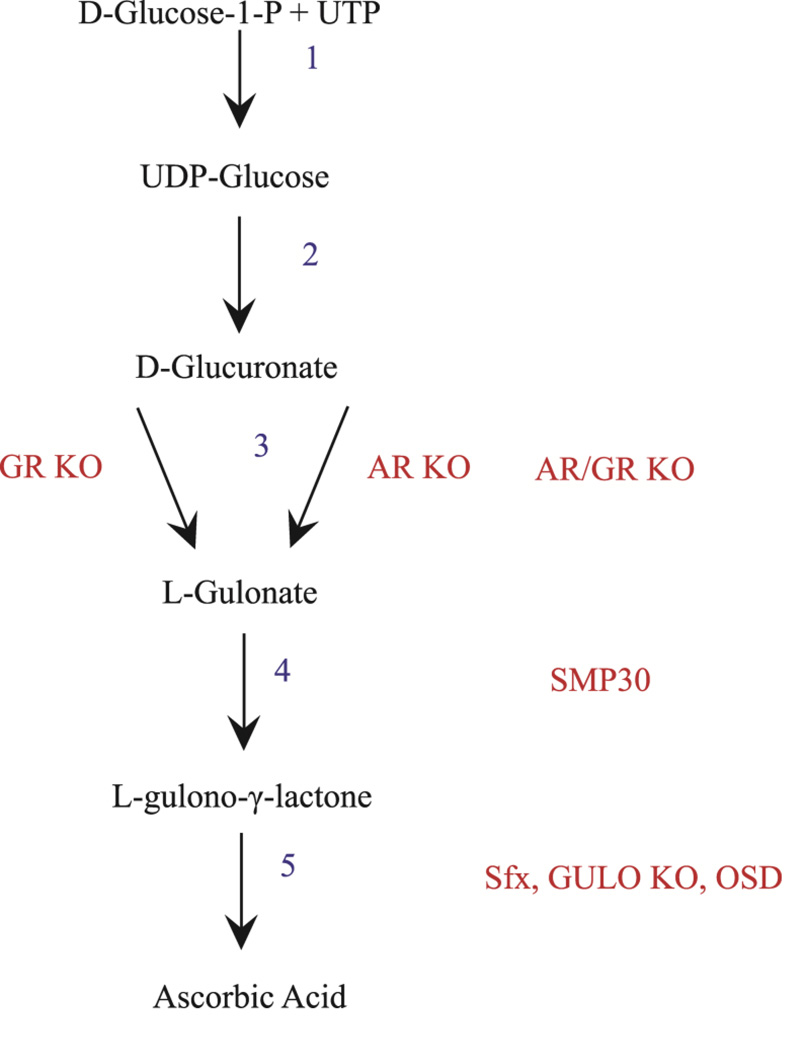
Kuva 1: AR- (aldosareduktaasi) ja GR- (aldehydireduktaasi) mutaatiot vaikuttavat kahteen erilliseen osaan C-vitamiinin synteesireitin kolmannessa vaiheessa. AR/GRKO-mutaatio on kaksoispoistomutaatio, joka estää L-glukuronaatin muuttumisen L-gulonaatiksi. SMP30 on mutaatio synteesin neljännessä vaiheessa ja vaikuttaa gulonolaktonaasiin, estäen L-gulonaatin muuttumisen L-gulono-γ-laktoniksi. Sfx, GULOKO ja OSD vaikuttavat synteesin viidenteen vaiheeseen ja ovat erillisiä L-gulono-γ-laktonoksidaasin mutaatioita, jotka muuttavat L-gulono-γ-laktonin askorbiinihapoksi. Mutaatioiden nimet on merkitty punaisella, välivaiheet mustalla ja vaiheiden numerot sinisellä.
Varhaisimmat C-vitamiinin vaikutusta luustoon tutkineet mallieläimet
Yksi varhaisimmista malliorganismeista, joita käytettiin C-vitamiinin vaikutusten tutkimiseen luustossa, oli marsu, sillä tämä selkärankainen laji ei omaa GULO-geeniä ja ei siksi kykene katalysoimaan C-vitamiinin biosynteesin viimeistä vaihetta. Geenirakenteen ja fylogeneettisten analyysien perusteella on havaittu, että selkärankaisten GULO-geeneillä on 64–95 % aminohappojen yhtenevyys ja ne koostuvat 11:stä säilyneestä eksonista(42). Marsuilla ja korkeammilla kädellisillä GULO-geeni on kuitenkin inaktiivinen mutaatioiden vuoksi, jotka tapahtuivat noin 20 miljoonaa vuotta sitten(43,44). Varhaiset marsututkimukset osoittivat, että AA-puutokset estivät kollageenin asianmukaista synteesiä(45) ja että reisiluun kollageenin synteesin toimintahäiriö johtui vähentyneestä hydroksiproliinipitoisuudesta(46). Tämä johti lisätutkimuksiin, joissa osoitettiin, että AA-puutteellisilla marsuilla oli vähentynyt luun hohkarakenteen lukumäärä ja paksuus, mutta lisääntynyt hohkaluuväli sääriluussa. Reisiluun pituus ja luun tilavuustiheys olivat myös vähentyneet keripukkisilla eläimillä, vaikka luun lujuus pysyi muuttumattomana(47). Keripukkiset marsut osoittavat merkittävästi vähentynyttä ALP-aktiivisuutta sekä luussa että seerumissa verrattuna AA:lla täydennettyä ruokavaliota saaneisiin(48).
Toisin kuin marsut, rotat ja hiiret pystyvät syntetisoimaan C-vitamiinia eivätkä tarvitse sitä ravinnosta. Tästä syystä on kehitetty geenipoistomalleja, joissa on mukana erityisiä C-vitamiinin synteesin ja solukuljetusjärjestelmien molekyylikomponentteja, jotta voidaan tutkia C-vitamiinin puutteen vaikutuksia sekä luustossa että muissa kudoksissa (Taulukko 1). Kolme jyrsijämallia, osteogeeninen häiriö Shionogi (ODS) -rotta, GULO KO -hiiri ja spontaani murtumahiiri (sfx), kohdistuu GULO-geeniin, joka on välttämätön L-gulono-γ-laktonin muuttamiseksi AA:ksi ja puuttuu ihmisiltä. Sfx-hiiri on koko geenin deleetion tulos(49,50), kun taas ODS-rotta ja GULO KO -hiirimallit ovat seurausta missense-mutaatiosta (G->A nukleotidi 182, Cys->Tyr aminohappo 61)(51) ja eksonien 3–7 insertiomuunnoksista (eli geeniloukku)(52). Näissä malleissa esiintyy samankaltaisia luustofenotyyppejä, kuten spontaani murtuminen, vähentynyt kortikaalinen paksuus ja vähentynyt metafyysisen hohkarakenteen lukumäärä ja painon lasku verrattuna villityypin eläimiin(49,53–55).
Taulukko 1. C-vitamiinin geenimuunnellut eläinmallit
| Mutaatio | Eläin | Geeni | Mutaatiotyyppi | Fenotyyppi | Lähde |
|---|---|---|---|---|---|
| ODS | Rotta | L-gulono-γ-laktonoksidaasi | Missense-mutaatio Cys 61-Tyr 61 | Spontaanit murtumat, hohkarakenteen puuttuminen, vähentynyt kortikaalivyöhyke | (Kawai ym., 1992; Mizushima ym., 1984)(51,103) |
| GULO KO | Hiiri | L-gulono-γ-laktonoksidaasi | Geeniloukku, eksonit 3–7 | Spontaanit murtumat, hohkarakenteen puuttuminen, vähentynyt kortikaalivyöhyke | (Maeda ym., 2000)(52) |
| Sfx | Hiiri | L-gulono-γ-laktonoksidaasi | Geenipoisto | Spontaanit murtumat, hohkarakenteen puuttuminen, vähentynyt kortikaalivyöhyke | (Mohan ym., 2005; Jiao ym., 2005; Beamer ym., 2000)(49,50,57) |
| AR KO | Hiiri | Aldosareduktaasi | Eksonin 9 poisto | Ei luustofenotyyppiä | (Gabbay ym., 2010)(40) |
| GR KO | Hiiri | Aldehydireduktaasi | Geeniloukku, introni 1 | Altis osteoporoosille oksidatiivisen stressin/matalan AA-tason alaisena | (Gabbay ym., 2010)(40) |
| AR/GR KO | Hiiri | AR/GR | AR/GR risteytys | Spontaanit murtumat, hohkarakenteen puuttuminen, vähentynyt kortikaalivyöhyke | (Gabbay ym., 2010)(40) |
| SMP-30 | Hiiri | Gulonolaktonaasi | Geeniloukku, eksoni 3 | Spontaanit murtumat, hohkarakenteen puuttuminen, vähentynyt kortikaalivyöhyke | (Ishigami ym., 2002)(104) |
Kaikki olennaiset C-vitamiiniin liittyvät mutaatiot hiirillä ja rotilla, järjestettynä geenin, geenimutaation ja kyseisen mutaation vaikutusten mukaan.
ODS-rotan häntäselkänikamien ja muiden mallien vaikutukset C-vitamiinin puutteessa
Tuntemattomista syistä ODS-rottien häntäselkänikamat näyttävät pysyvän ennallaan, mikä viittaa siihen, että GULO-mutaation aiheuttama AA-puutos vaikuttaa vähän tai ei lainkaan selkänikamien ylläpitoon ja korjaukseen(56). ODS-rottien selkärangassa on kuitenkin muodonmuutoksia, samoin kuin kasvun hidastumista vartalon ja raajojen akselilla(55). Epifyysilevy on pienentynyt ja kondrosyyttien määrä vähentynyt ODS-rottien luissa(56). Osteoblastit eivät osoita kuutiomaista muotoa, vaan ne ovat pyöreitä ja sijaitsevat luun pinnalla, jolta puuttuu osteoidikerros. Osteoklastien määrä ei lisäänny, mikä viittaa siihen, että kasvun hidastuminen johtuu todennäköisesti toimintahäiriöisistä tai vähentyneistä osteoblastipopulaatioista(55).
GULO KO -hiirillä näyttää myös olevan heikentynyt osteogeneesi, mikä ilmenee alentuneina kiertävän osteokalsiinin määrinä, mikä viittaa puutteisiin luunmuodostusprosessissa(52,54). Vähentyneen hohkaluun määrän lisäksi GULO KO -hiirillä ilmenee myös aortan seinämän vaurioita(52,54). Vaikka GULO KO -hiirien luustofenotyypeistä on vähän tutkimuksia, me ja muut olemme osoittaneet, että koko GULO-geenin deleetio on syynä heikentyneeseen osteoblastien erilaistumiseen, vähentyneeseen luunmuodostukseen ja spontaaniin murtumiseen sfx-hiirissä(49,57). Homotsygoottiset sfx-hiiret painavat merkittävästi vähemmän kuin villityyppiset hiiret, niillä ei käytännössä ole osteoidikerrosta tai hohkaluuta kasvulevyn lähellä, ja niiden kasvulevy on hyvin ohut, mikä viittaa hypertrofisten kondrosyyttien inaktiivisuuteen(57). Reisiluun periosteaalinen luunmuodostusnopeus (BFR) ja mineraalin kertymisnopeus (MAR) ovat huomattavasti alhaisempia sfx-mutanteilla verrattuna villityypin hiiriin (BFR 10−3 mm/päivä [sfx 1.137 ± 0.692, villityyppi 14.951 ± 3.552], MAR µm/päivä [sfx 1.128 ± 0.318, villityyppi 5.170 ± 1.782]). Tibian BMD on 64 % ja reisiluun BMD 73 % villityypin tasosta 35 päivän iässä(49). Sfx-hiirillä on alentunut insuliinin kaltaisen kasvutekijä I:n (IGF-I) ilmentyminen ja lievä ALP:n väheneminen, mutta hyvin samankaltaisesti kuin GULO KO -hiirillä, seerumin osteokalsiinipitoisuus on erittäin matala(57).
Toinen C-vitamiinin puutteen jyrsijämalli sisältää mutaation senescence marker protein 30 (SMP30) -geenissä, joka vastaa gulonolaktonaasi-entsyymistä ja L-gulonaatin muuntamisesta L-gulono-γ-laktoniksi, mikä on C-vitamiinin biosynteesireitin toiseksi viimeinen vaihe. SMP30-hiiret voivat vaihtoehtoisesti muuntaa D-glukuronaatin D-gulono-γ-laktoniksi, joka voi sitten isomerisoitua L-gulono-γ-laktoniksi, kiertäen käytännössä L-gulonaattivaiheen tarpeen tai SMP30:n tarpeen. SMP30-hiirien käsittely D-gulono-γ-laktonilla lisää AA:n pitoisuutta virtsassa vähintään 30-kertaisesti. Tämä toissijainen reitti ei kuitenkaan tuota endogeenisesti riittäviä L-gulono-γ-laktonitasoja korvaamaan SMP30:n tarvetta(58,59). Hyvin samankaltaisesti kuin ODS-rotat, GULO KO -hiiret ja sfx-hiiret, SMP30 KO -hiiret osoittavat keripukille tyypillisiä luusto-oireita, kuten spontaanit raajamurtumat, kortikaalisen paksuuden ja hohkarakenteen lukumäärän väheneminen verrattuna villityypin hiiriin(60). SMP30-hiirillä on myös merkkejä rachitis-rosarysta ja alentunut subkalloninen BMD verrattuna villityypin hiiriin (noin 80 % villityypin BMD:stä)(58). Lisäksi osteoklastien erilaistumisen tärkeä välittäjä, RankL, on lisääntynyt SMP30 KO -hiirillä samalla kun osteoblastien määrä on vähentynyt(60).
Kolme muuta KO-hiirimallia on kehitetty C-vitamiinin synteesireitillä olevien aldehydireduktaasi (GR) ja aldosareduktaasi (AR) -entsyymien avulla. GR-geenin mutaatio introni 1:ssä geeniloukutusmenetelmällä tuottaa hiiriä (GR KO), jotka kasvavat normaalisti mutta ovat alttiita osteoporoosille oksidatiivisen stressin tai alhaisen AA-saannin yhteydessä. AR-eksonin 9 poisto (AR KO) johtaa lievästi vähentyneeseen AA:n tuotantoon (noin 15 %), mutta ei näkyvää luustofenotyyppiä. Sen sijaan kaksois-KO-hiiret (AR/GR KO) kehittävät keripukkimaisia oireita, joiden luustopiirteet muistuttavat sfx-, GULO KO-, SMP30-hiiriä ja ODS-rottia(40).
On tärkeää huomata, että nämä fenotyypit voidaan palauttaa C-vitamiinin nauttimisella, mikä viittaa siihen, että fenotyypit eivät johdu ODS-, SMP30-, GULO KO- tai AR/GR KO -mutaation toissijaisista vaikutuksista, vaan pikemminkin ne johtuvat yksinomaan C-vitamiinin puutteesta. Jokaisessa näistä KO-malleista näyttää siltä, että luun muodostus on enemmän heikentynyt kuin luun resorptio. Näiden tietojen perusteella voidaan päätellä, että heikentynyt luun muodostus, joka johtuu osteoblastien toimintahäiriöstä, on AA-puutoksen aiheuttaman alhaisen BMD:n, hohkarakenteen lukumäärän ja kortikaalipaksuuden tärkein syy. Tämä johtaa osteoporoosiin ja lisääntyneeseen murtumariskin.
C-vitamiinin vaikutus prolyyli- ja lysyylihydroksylaaseihin ja geeniekspressioon
On hyvin osoitettu, että AA on tärkeä kofaktori monille prolyyli- ja lysyylihydroksylaaseille, jotka osallistuvat monien transkriptiotekijöiden säätelyyn sekä kollageenin muodostumiseen ja kypsymiseen. Prolyyli- ja lysyylihydroksylaaseilla on monia tehtäviä solussa. Yksi näistä tehtävistä on säädellä tiettyjen proliini- ja lysiinitähteiden hydroksylaatiota kollageenimolekyylissä, mikä on olennaista kollageeniverkoston ristisidonnalle ja normaalin kypsän kollageeniverkoston ylläpidolle(1,2,7). Prolyylihydroksylaasialueen (PHD) proteiinit, jotka aktivoituvat AA:n vaikutuksesta, voivat indusoida myös muiden proteiinien, kuten hypoksiasta indusoituvien tekijöiden (HIF), proliinitähteiden hydroksylaatiota. Normoksian vallitessa ja Fe2+:n, 2-oksoglutaraatin sekä AA:n läsnä ollessa PHD-proteiinit aktivoituvat indusoimaan HIF:ien tiettyjen säilyneiden proliinitähteiden hydroksylaatiota. Hydroksyloituneet HIF:t vuorovaikuttavat von Hippel-Lindaun kasvainestäjäproteiinin (pVHL) β-alueen kanssa ja ubiquitinoidaan tämän jälkeen pVHL-E3-ligaasikompleksin avulla, mikä merkitsee HIF:t 26S-proteasomin hajotettavaksi(88,89). Näin ollen AA:n aiheuttama PHD-aktivaatio voi osittain säädellä luusolujen toimintoja säätelemällä HIF:ien ja muiden transkriptiotekijöiden proteiinitasoja.
Vahvistuksena PHD-proteiinien tärkeästä roolista AA:n vaikutusten välittäjänä osterixin ilmentymiseen ja osteoblastien erilaistumiseen on osoitettu, että PHD-estäjillä tapahtuva käsittely estää AA:n aiheuttaman osterixin ilmentymisen ja osteoblastien erilaistumisen(89,90). Määrittääksemme PHD2:n roolin osteoblasteissa, katkaisimme ehdollisesti PHD2-geenin I-tyypin kollageenia tuottavissa osteoblasteissa(91). Näissä tutkimuksissa havaittiin, että hiirillä, joilta oli poistettu Phd2-geenin toiminta osteoblasteissa, oli merkittäviä vähennyksiä luun koossa ja hohkaluun määrässä, mikä johtui heikentyneestä luunmuodostuksesta eikä luun resorptiosta. PHD2:n menetyksen seurauksena osteoblasteissa oli vähentynyt osterixin, osteokalsiinin ja luun sialoproteiinin ilmentyminen, mikä viittaa siihen, että PHD2:lla on tärkeä rooli luunmuodostuksen säätelyssä osittain osterixin ja luun muodostumisen markkerigeenien ilmentymisen kautta.
Toisin kuin PHD2:n positiiviset vaikutukset osteoblasteissa, laboratoriomme viimeaikaiset tutkimukset, joissa tutkittiin PHD2:n ehdollista katkaisemista kondrosyyteissä, ovat paljastaneet vastakkaisen vaikutuksen PHD2:lle kondrosyyteissä. PHD2:n ehdollinen poistaminen kollageeni 2 positiivisista (Col2+) kondrosyyteistä johtaa dramaattiseen lisääntymiseen endokondraalisessa luunmuodostuksessa ja hohkaluun määrässä useissa luustokohteissa. Lisääntynyt luunmuodostus johtuu kondrosyyttien ja osteoblastien lisääntyneestä toiminnasta, mikä ilmenee osterixin, ALP:n ja luun sialoproteiinin sekä HIF1α:n ja kondrogeneettisten geenien, kuten Col2:n ja Sox9:n, ilmentymisen huomattavina lisääntyminä(95). PHD2:n inhibitio kondrosyyteissä lisää myös ruston korjauspotentiaalia estämällä HIF2α:n hajoamista, joka toimii rustoa säätelevän Sox9:n ilmentymisen ylöspäin säätelevänä tekijänä(96). Näiden tulosten perusteella näyttää siltä, että PHD2 säätelee negatiivisesti endokondraalisia luunmuodostusta estämällä HIF1α-reittiä.
Toinen jännittävä mekanismi, jolla C-vitamiini säätelee geenien transkriptiota, on epigeneettinen geenitoiminnan muokkaus. DNA:n metyloituminen sytosiinin 5-asemassa on tärkein nisäkkäiden DNA:n kovalenttinen muokkaus, jolla on keskeinen rooli geenitranskription säätelyssä. AA indusoi Ten-Eleven Translocation (Tet) 1/2:n toimintaa toimimalla entsymaattisena kofaktorina 5-metyylisytosiinin (5-mC) hydroksylaatiossa. Tällä tavoin se ylöspäin säätelee transkriptiota geeneissä, joilla on tyypillisesti hypermetyloituja alueita; kuitenkin se tekee tämän lisäämättä Tet-ilmentymistä(98,99). Tet2 edistää hematopoieettista erilaistumista ja hiirillä, joilla on Tet2-puutoksia, kehittyy myeloidisia maligniteetteja ja ne kuolevat lopulta(99,100). Blaschke ym.(98) osoittivat, että Tet1/2:n alenemisella estettiin AA:n indusoima metyylisytosiinin hydroksylaatio hiiren alkion kantasoluissa, mikä viittaa siihen, että C-vitamiini on suora Tet-toiminnan ja DNA-metylaation tarkkuuden säätelevä tekijä. Tämä uusi C-vitamiinin funktio Tet:n välittämässä hydroksimetyylisytosiinin tuotannossa tukee askorbaattia kriittisenä välittäjänä genomin ja ympäristön rajapinnassa(99).
Tulevat tutkimuskohteet
Huolimatta pyrkimyksistä poistaa C-vitamiinin puutokset lisäämällä sitä elintarvikkeisiin, C-vitamiinin puutokset ja riittämättömyys jatkuvat, ja ne todennäköisesti vaikuttavat heikentävästi luuston terveyteen. Vaikka C-vitamiinia saataisiin riittävästi, mikä tahansa mekanismi (esim. C-vitamiinikuljettajat, DHAA:n pelkistys AA:ksi) voi vaikuttaa solujen C-vitamiinitasoihin. Lisäksi pienet geneettiset muutokset missä tahansa C-vitamiinireitin signalointiin osallistuvassa geenissä kohdesolutyypeissä voivat johtaa muutoksiin luunmuodostuksessa (Kuva 2, Kuva 3). Näin ollen tulevaisuudessa AA-reittiin liittyvien geenialleelien polymorfismien selvittäminen ja polymorfismien sekä luunmuodostuksen välisen yhteyden selventäminen voisi johtaa parempaan ymmärrykseen siitä, kuinka tämä reitti vaikuttaa ihmisen luuston ylläpitoon.
Kuva 2. Solunsisäiset C-vitamiinin mekanismit ja kuljetus.
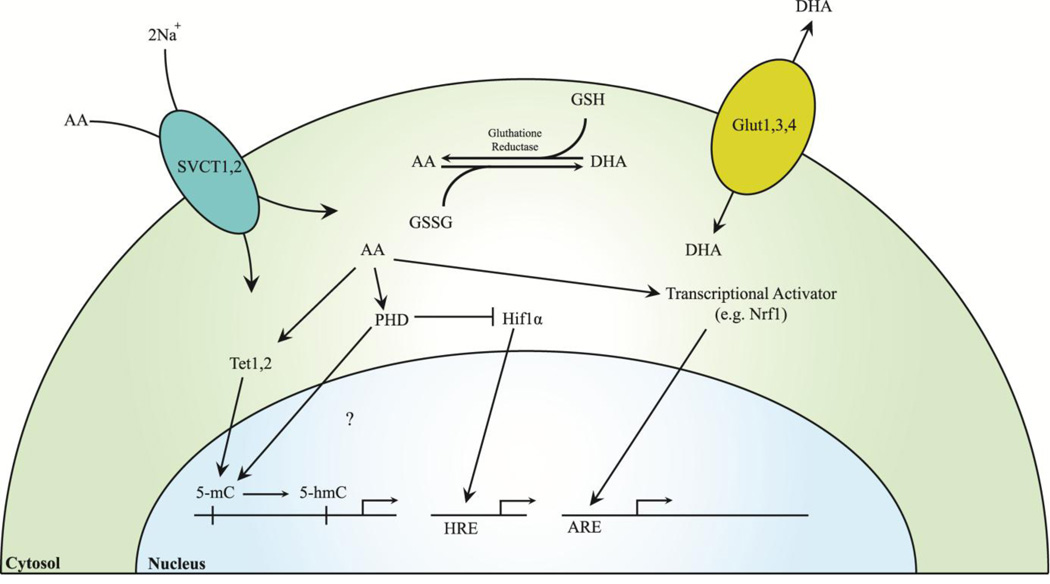
Selite: SCVT 1/2 vastaavat AA:n ionivälitteisestä kuljetuksesta soluihin, kun taas Glut 1/3/4 kuljettaa DHA:ta. AA- ja DHA-tiloja säätelee glutationireduktaasi. AA indusoi transkriptiota aktivoivien tekijöiden, kuten Nrf1:n, tumakulkeutumista, jotka sitoutuvat ARE-alueisiin ja aktivoivat luun proliferaatioon/erilaistumiseen liittyvien tekijöiden transkription sekä Tet 1/2, jotka hydroksyloivat 5-mC:tä, poistaen näin epigeneettisen hiljentämisen. AA aktivoi PHD:tä, jotka aktivoivat HIF:ien hajotusta ja voivat hydroksyloida 5-mC:tä. HIF:t sitoutuvat HRE-alueisiin, jotka voivat toimia luun erilaistumisen tai apoptoosin transkriptiota aktivoivina tekijöinä. Lyhenteet: 5-mC, 5-metyylisytosiini; 5-hmC, 5-hydroksimetyylisytosiini; AA, askorbiinihappo; ARE, antioksidanttiresponssielementti; DHA, dehydroaskorbiinihappo; Glut, glukoosikuljettaja; GSH, glutationi; GSSG, glutationidisulfidi; HIF, hypoksiasta indusoituva tekijä; HRE, hypoksiaresponssielementti; Nrf1, tumatekijä-E2-sukuinen tekijä; PHD, prolyylihydroksylaasialueen proteiini; SVCT, natriumriippuvainen C-vitamiinikuljettaja-1; Tet, ten-eleven translocation -proteiini.
Kuva 3. C-vitamiinin eriytyneet vaikutukset eri solutyyppeihin.
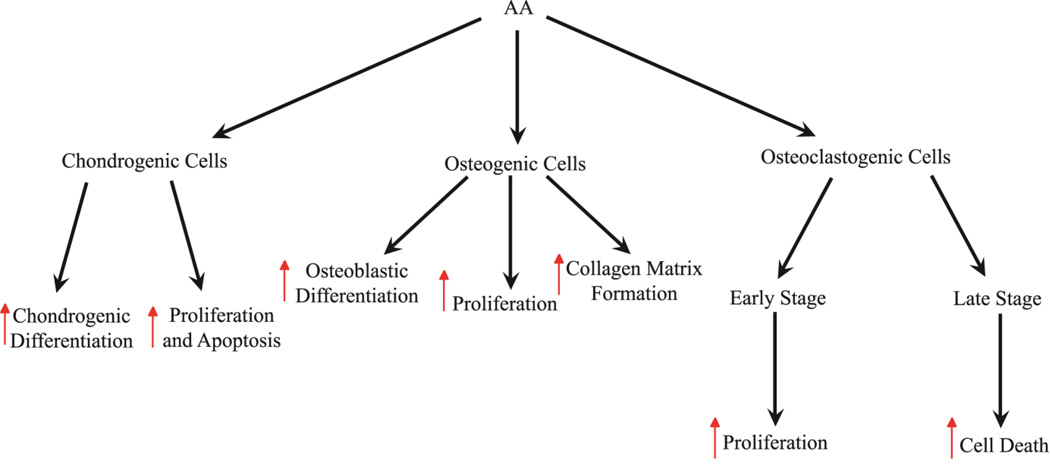
Selite: AA indusoi kondrogeneettisten solujen erilaistumista ja ylläpitoa (lisääntynyt proliferaatio ja apoptoosi). AA edistää kollageenimatriisin muodostumista sekä osteoblastien erilaistumista ja proliferaatiota osteogeenisissä soluissa. Varhaisen vaiheen osteoklasteissa AA lisää proliferaatiota, kun taas myöhäisen vaiheen osteoklasteissa AA lisää solukuoleman ylöspäin säätelyä. Punaiset nuolet osoittavat solun ominaisuuden ylöspäin säätelyä.
C-vitamiinipuutoksen vaikutukset luuston eri osiin ja tulevat tutkimuskohteet
GULO-geenin mutaation aiheuttama C-vitamiinipuutus aiheutti merkittävän luumassan vähenemisen pitkissä luissa, mutta ei selkänikamissa(49). Tämän mukaisesti spontaanit murtumat havaittiin pääasiassa pitkissä luissa spontaanin murtumamutantti-hiirillä, joilla oli GULO-geenin deleetio(57). Mielenkiintoista on, että PHD2:n deleetio I-tyypin kollageenia ilmentävissä osteoblasteissa aiheutti myös eriytyneitä vaikutuksia pitkissä luissa verrattuna selkänikamiin. PHD2:n menettäminen osteoblasteissa vähensi hohkaluun määrää reisiluussa, mutta ei selkänikamissa(91). Lisäksi geneettiset linkitystutkimukset osoittavat, että geenit, jotka vaikuttavat huippuluumassan vaihteluun, ovat luustokohteen mukaan riippuvaisia(101). Nämä tiedot viittaavat siihen, että C-vitamiinisignalointireittiä tulisi hyödyntää hoitojen kehittämiseksi lonkkamurtumien, ihmisten heikentävimpien osteoporoottisten murtumien, hoitoon.
Vaikka AA tunnetaan PHD-entsyymien kofaktorina, PHD2:n deleetio osteoblasteissa ja kondrosyyteissä tuotti vastakkaisia luustofenotyyppejä. Jotta sen toiminnan mekanismi ymmärrettäisiin paremmin, on tärkeää tunnistaa lisää PHD2:n hydroksylaation ja ubiquitinaation kohteita (transkriptiota modifioivia tekijöitä). PHD2:n alasajo johti PHD3:n ilmentymisen dramaattiseen kasvuun sekä osteoblasteissa että kondrosyyteissä(91). PHD3:n rooli näiden kahden solutyypin toimintojen säätelyssä on kuitenkin tuntematon. Lisäksi on osoitettu, että AA:lla on erilaisia vaikutuksia osteoklasteihin niiden erilaistumisvaiheesta riippuen. C-vitamiinin tiedetään myös säätelevän muiden solutyyppien, kuten neuronien, myoblastien ja keratinosyyttien, erilaistumista. On tärkeää tutkia, onko PHD-välitteinen mekanismi mukana välittämässä C-vitamiinin vaikutuksia näissä muissa solutyypeissä.
C-vitamiinin säätelemä Tet on tärkeä geenien säätelyssä alkion kantasoluissa, ja se edustaa merkittävää löydöstä tällä alalla. C-vitamiinin vaikutus metyylisytosiinin hydroksylaatioon tarjoaa mielenkiintoisen tutkimusväylän AA:n transkription säätelemiseksi koko genomitasolla. Vaikka AA:n vaikutus proteiinien hydroksylaatioon PHD:n kautta on hyvin tutkittu, kysymys siitä, ovatko PHD:t myös mukana metyylisytosiinin hydroksylaatiossa, jää mielenkiintoiseksi mahdollisuudeksi. Tässä yhteydessä on näyttöä siitä, että PHD:t sijaitsevat tumassa(102). Näin ollen AA:n vaikutus geenitranskriptioon genomin aktiivisuuden epigeneettisen muokkauksen kautta PHD:iden välityksellä tarjoaa uuden mekanismin C-vitamiinikohdegeenien säätelyyn, konsepti, joka tulee testata kokeellisesti tulevissa tutkimuksissa.
Lisätutkimusten tarve ja johtopäätökset
Lisää epidemiologisia tutkimuksia tarvitaan C-vitamiinin vaikutuksen paremmaksi ymmärtämiseksi ihmisen luustossa. Kuten Finck ym.(15) osoittivat, vaikka erilaisia tutkimustyyppejä on monia, monet niistä eivät sisällä asianmukaisia kontrollimuuttujia (esim. lumekontrolloidut satunnaistetut kliiniset kokeet, riittävät otoskoot jne.) johdonmukaisten tulosten saamiseksi. Siksi epidemiologisissa tutkimuksissa on otettava huomioon tiukat muuttujakontrollit.
Johtopäätökset
AA on osoitettu olevan elintärkeä osteogeenisen ja kondrogeenisen erilaistumisen säätelijä. Selkärankaisilla, joilta puuttuvat normaalit fysiologiset AA-tasot, kehittyy luusairauksia, kuten spontaaneja murtumia, heikentynyttä luun kasvua ja heikentynyttä luun paranemista. Näin ollen AA:n vaikutus luuston terveyteen on keskeinen, ja se on osoittautunut säätyvän useiden monimutkaisten vuorovaikutusmekanismien kautta. Vaikka ihmistutkimuksissa on jonkin verran epäjohdonmukaisuutta, useimmat osoittavat, että vähentynyt seerumin C-vitamiinitaso tai saanti voi olla yhteydessä osteoporoosin kehittymiseen ja lisääntyneeseen murtumariskiin. Uusien hoitomuotojen kehittämiseksi C-vitamiinipuutteiden hoitoon on tärkeää ymmärtää kaikki ne menetelmät, joiden kautta se imeytyy ja muokkautuu solussa toiminnallisesti merkitykselliseksi. Tämä sisältää sen antioksidanttitoiminnot, mutta myös sen roolin kofaktorina, joka osallistuu geenisäätelyyn ja voi vaikuttaa luun kehitykseen ja uudistumiseen. C-vitamiinin alavirran vaikutusten tunnistaminen ja niiden vuorovaikutusmekanismien ymmärtäminen tarjoavat lisää kohteita luustoon liittyvien sairauksien hoitoon. Lisäksi luuston terveys ei perustu pelkästään AA-riippuvaisiin mekanismeihin, ja muiden mekanismien olemassaolo tarjoaa arvokkaita tutkimusmahdollisuuksia useiden luunsäätelijöiden synergistisen vaikutuksen selvittämiseksi.
Kiitokset
Tätä tutkimusta tuki Veterans Administration BLR&D merit -tutkimusapuraha 1-101-BX-001396 SM:lle ja National Institutes of Arthritis and Musculoskeletal Diseases R01 -apuraha AR048139 SM:lle. Tekijät haluavat kiittää tohtori Donna Strongia käsikirjoituksen oikolukemisesta.
Ilmoitukset
Kaikki tekijät ilmoittavat, ettei heillä ole eturistiriitoja.
Tekijöiden roolit
Käsikirjoituksen luonnostelu: PA, SH ja SM. Käsikirjoituksen sisällön tarkistaminen: PA, SH, MW ja SM. Käsikirjoituksen lopullisen version hyväksyminen: SM.
Lähteet
- Walmsley AR, Batten MR, Lad U, Bulleid NJ. Prokollageenin solunsisäinen pidättyminen endoplasmakalvostossa on prolyyli 4-hydroksylaasin välittämää. The Journal of biological chemistry. 1999;274(21):14884–14892. doi: 10.1074/jbc.274.21.14884. [DOI] [PubMed] [Google Scholar]
- Marini JC, Cabral WA, Barnes AM, Chang W. Kollageenin prolyyli 3-hydroksylaasikompleksin osat ovat ratkaisevan tärkeitä normaalille luuston kehitykselle. Cell cycle. 2007;6(14):1675–1681. doi: 10.4161/cc.6.14.4474. [DOI] [PubMed] [Google Scholar]
- Geber J, Murphy E. Keripukki Irlannin suuren nälänhädän aikana: todisteita C-vitamiinin puutteesta 1800-luvun puolivälin luustoväestöstä. American journal of physical anthropology. 2012;148(4):512–524. doi: 10.1002/ajpa.22066. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Pimentel L. Keripukki: historiallinen katsaus ja nykyinen diagnosointitapa. The American journal of emergency medicine. 2003;21(4):328–332. doi: 10.1016/s0735-6757(03)00083-4. [DOI] [PubMed] [Google Scholar]
- Levavasseur M, Becquart C, Pape E, et al. Vaikea keripukki: aliarvioitu sairaus. European journal of clinical nutrition. 2015 doi: 10.1038/ejcn.2015.99. [DOI] [PubMed] [Google Scholar]
- Murad S, Grove D, Lindberg KA, Reynolds G, Sivarajah A, Pinnell SR. Kollageenisynteesin säätely askorbiinihapolla. Proceedings of the National Academy of Sciences of the United States of America. 1981;78(5):2879–2882. doi: 10.1073/pnas.78.5.2879. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Franceschi RT, Iyer BS, Cui Y. Askorbiinihapon vaikutukset kollageenimatriisin muodostukseen ja osteoblastien erilaistumiseen hiiren MC3T3-E1-soluissa. Journal of bone and mineral research : the official journal of the American Society for Bone and Mineral Research. 1994;9(6):843–854. doi: 10.1002/jbmr.5650090610. [DOI] [PubMed] [Google Scholar]
- Villacorta L, Azzi A, Zingg JM. Vitamiinien E ja C säätelevä rooli verisuonijärjestelmän soluväliainekomponenteissa. Molecular aspects of medicine. 2007;28(5–6):507–537. doi: 10.1016/j.mam.2007.05.002. [DOI] [PubMed] [Google Scholar]
- May JM, Harrison FE. C-vitamiinin rooli verisuonten endoteelissä. Antioxidants & redox signaling. 2013;19(17):2068–2083. doi: 10.1089/ars.2013.5205. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Ashor AW, Siervo M, Lara J, Oggioni C, Afshar S, Mathers JC. C- ja E-vitamiinilisän vaikutus endoteelitoimintaan: systemaattinen katsaus ja meta-analyysi satunnaistetuista kontrolloiduista tutkimuksista. The British journal of nutrition. 2015;113(8):1182–1194. doi: 10.1017/S0007114515000227. [DOI] [PubMed] [Google Scholar]
- May JM. C-vitamiinin kuljetus ja sen rooli keskushermostossa. Sub-cellular biochemistry. 2012;56:85–103. doi: 10.1007/978-94-007-2199-9_6. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Harrison FE, Bowman GL, Polidori MC. Askorbiinihappo ja aivot: perusteet käytölle kognitiivisen heikentymisen estämisessä. Nutrients. 2014;6(4):1752–1781. doi: 10.3390/nu6041752. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Catani MV, Savini I, Rossi A, Melino G, Avigliano L. C-vitamiinin biologinen rooli keratinosyyteissä. Nutrition reviews. 2005;63(3):81–90. doi: 10.1111/j.1753-4887.2005.tb00125.x. [DOI] [PubMed] [Google Scholar]
- Monsen ER. Antioksidanttien suositellut päivittäiset saannit: C-vitamiini, E-vitamiini, seleeni ja karotenoidit. Journal of the American Dietetic Association. 2000;100(6):637–640. doi: 10.1016/S0002-8223(00)00189-9. [DOI] [PubMed] [Google Scholar]
- Finck H, Hart AR, Jennings A, Welch AA. Onko C-vitamiinilla roolia osteoporoosin ja murtumien ehkäisyssä? Katsaus mahdollisiin mekanismeihin ja nykyisiin epidemiologisiin todisteisiin. Nutr Res Rev. 2014;27(2):268–283. doi: 10.1017/S0954422414000195. [DOI] [PubMed] [Google Scholar]
- Hall SL, Greendale GA. Ruokavalion C-vitamiinin saannin suhde luun mineraalitiheyteen: PEPI-tutkimuksen tulokset. Calcified tissue international. 1998;63(3):183–189. doi: 10.1007/s002239900512. [DOI] [PubMed] [Google Scholar]
- New SA, Bolton-Smith C, Grubb DA, Reid DM. Ravitsemuksen vaikutukset luun mineraalitiheyteen: poikkileikkaustutkimus premenopausaalisilla naisilla. The American journal of clinical nutrition. 1997;65(6):1831–1839. doi: 10.1093/ajcn/65.6.1831. [DOI] [PubMed] [Google Scholar]
- New SA, Robins SP, Campbell MK, et al. Ravitsemuksen vaikutukset luumassaan ja luuaineenvaihduntaan: lisätodisteita hedelmien ja vihannesten kulutuksen positiivisesta yhteydestä luuston terveyteen. The American journal of clinical nutrition. 2000;71(1):142–151. doi: 10.1093/ajcn/71.1.142. [DOI] [PubMed] [Google Scholar]
- Leveille SG, LaCroix AZ, Koepsell TD, Beresford SA, Van Belle G, Buchner DM. Ruokavalion C-vitamiini ja luun mineraalitiheys postmenopausaalisilla naisilla Washingtonin osavaltiossa, USA:ssa. Journal of epidemiology and community health. 1997;51(5):479–485. doi: 10.1136/jech.51.5.479. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Morton DJ, Barrett-Connor EL, Schneider DL. C-vitamiinilisän käyttö ja luun mineraalitiheys postmenopausaalisilla naisilla. Journal of bone and mineral research : the official journal of the American Society for Bone and Mineral Research. 2001;16(1):135–140. doi: 10.1359/jbmr.2001.16.1.135. [DOI] [PubMed] [Google Scholar]
- Pasco JA, Henry MJ, Wilkinson LK, Nicholson GC, Schneider HG, Kotowicz MA. Antioksidanttivitamiinilisät ja luun aineenvaihdunnan merkkiaineet tupakoimattomilla naisilla. Journal of women's health. 2006;15(3):295–300. doi: 10.1089/jwh.2006.15.295. [DOI] [PubMed] [Google Scholar]
- Simon JA, Hudes ES. Askorbiinihapon suhde luun mineraalitiheyteen ja itse ilmoitettuihin murtumiin Yhdysvaltojen aikuisilla. American journal of epidemiology. 2001;154(5):427–433. doi: 10.1093/aje/154.5.427. [DOI] [PubMed] [Google Scholar]
- Ilich JZ, Brownbill RA, Tamborini L. Luusto ja ravitsemus ikääntyneillä naisilla: proteiini, energia ja kalsium tärkeimpinä luun mineraalitiheyden tekijöinä. European journal of clinical nutrition. 2003;57(4):554–565. doi: 10.1038/sj.ejcn.1601577. [DOI] [PubMed] [Google Scholar]
- Sowers MR, Wallace RB, Lemke JH. Keski-säteiden luutiheyden korrelaatiot postmenopausaalisilla naisilla: yhteisötutkimus. The American journal of clinical nutrition. 1985;41(5):1045–1053. doi: 10.1093/ajcn/41.5.1045. [DOI] [PubMed] [Google Scholar]
- Wolf RL, Cauley JA, Pettinger M, et al. Vitamiinien ja kivennäisaineiden antioksidanttien ja luun mineraalitiheyden välisen suhteen puuttuminen: Women’s Health Initiative -tutkimuksen tulokset. The American journal of clinical nutrition. 2005;82(3):581–588. doi: 10.1093/ajcn.82.3.581. [DOI] [PubMed] [Google Scholar]
- Lumbers M, New SA, Gibson S, Murphy MC. Iäkkäiden naisten lonkkamurtumapotilaiden ravitsemustila: vertailu ikäryhmään, joka asuu kotona ja käy päiväkeskuksissa. The British journal of nutrition. 2001;85(6):733–740. doi: 10.1079/bjn2001350. [DOI] [PubMed] [Google Scholar]
- Sahni S, Hannan MT, Gagnon D, et al. C-vitamiinin kokonais- ja lisäsaannin suojaava vaikutus lonkkamurtuman riskiä vastaan – 17 vuoden seurantatutkimus Framingham Osteoporosis Study -tutkimuksesta. Osteoporosis international. 2009;20(11):1853–1861. doi: 10.1007/s00198-009-0897-y. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Prynne CJ, Mishra GD, O’Connell MA, et al. Hedelmä- ja vihannesmäärät ja luun mineraalitila: poikkileikkaustutkimus viidessä ikä- ja sukupuoliryhmässä. The American journal of clinical nutrition. 2006;83(6):1420–1428. doi: 10.1093/ajcn/83.6.1420. [DOI] [PubMed] [Google Scholar]
- Chuin A, Labonte M, Tessier D, et al. Antioksidanttien ja voimaharjoittelun yhdistetty vaikutus luun mineraalitiheyteen iäkkäillä naisilla: pilottitutkimus. Osteoporosis international. 2009;20(7):1253–1258. doi: 10.1007/s00198-008-0798-5. [DOI] [PubMed] [Google Scholar]
- Ruiz-Ramos M, Vargas LA, Fortoul Van der Goes TI, Cervantes-Sandoval A, Mendoza-Nunez VM. Askorbiinihapon ja alfatokoferolin lisäravinteet auttavat ehkäisemään oksidatiiviseen stressiin liittyvää luun menetystä iäkkäillä. J Nutr Health Aging. 2010;14(6):467–472. doi: 10.1007/s12603-010-0099-5. [DOI] [PubMed] [Google Scholar]
- Sahni S, Hannan MT, Gagnon D, et al. Korkea C-vitamiinin saanti on yhteydessä pienempään 4-vuotiseen luun menetykseen iäkkäillä miehillä. J Nutr. 2008;138(10):1931–1938. doi: 10.1093/jn/138.10.1931. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Kaptoge S, Welch A, McTaggart A, et al. Ruokavalion ravintoaineiden ja elintarvikeryhmien vaikutukset reisiluun yläosan luun menetykseen miehillä ja naisilla 7. ja 8. ikävuosikymmenellä. Osteoporosis international. 2003;14(5):418–428. doi: 10.1007/s00198-003-1391-6. [DOI] [PubMed] [Google Scholar]
- Sugiura M, Nakamura M, Ogawa K, et al. Antioksidanttivitamiinien ja karotenoidien saantiin liittyvät ruokavaliomallit ja luun mineraalitiheys: löydökset postmenopausaalisilta japanilaisilta naisilta. Osteoporosis international. 2011;22(1):143–152. doi: 10.1007/s00198-010-1239-9. [DOI] [PubMed] [Google Scholar]
- Falch JA, Mowe M, Bohmer T. Seerumin askorbiinihapon alhaiset tasot iäkkäillä lonkkamurtumapotilailla. Scand J Clin Lab Invest. 1998;58(3):225–228. doi: 10.1080/00365519850186616. [DOI] [PubMed] [Google Scholar]
- Martinez-Ramirez MJ, Palma Perez S, Delgado-Martinez AD, Martinez-Gonzalez MA, De la Fuente Arrillaga C, Delgado-Rodriguez M. C-vitamiini, B12-vitamiini, foolihappo ja osteoporoottisten murtumien riski. Tapaus-verrokkitutkimus. Int J Vitam Nutr Res. 2007;77(6):359–368. doi: 10.1024/0300-9831.77.6.359. [DOI] [PubMed] [Google Scholar]
- Maggio D, Barabani M, Pierandrei M, et al. Plasman antioksidanttien merkittävä lasku ikääntyneillä osteoporoottisilla naisilla: poikkileikkaustutkimuksen tulokset. J Clin Endocrinol Metab. 2003;88(4):1523–1527. doi: 10.1210/jc.2002-021496. [DOI] [PubMed] [Google Scholar]
- Park HM, Heo J, Park Y. Kasvipohjainen kalsium on hyödyllinen osteoporoosin riskin alentamisessa postmenopausaalisilla korealaisilla naisilla. Nutr Res. 2011;31(1):27–32. doi: 10.1016/j.nutres.2010.12.005. [DOI] [PubMed] [Google Scholar]
- Dawber TR, Meadors GF, Moore FE., Jr. Epidemiologiset lähestymistavat sydänsairauksiin: Framingham Study. Am J Public Health Nations health. 1951;41(3):279–281. doi: 10.2105/ajph.41.3.279. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Maimoun L, Simar D, Caillaud C, et al. Antioksidanttien ja liikunnan vaikutus luuston aineenvaihduntaan. J Sports Sci. 2008;26(3):251–258. doi: 10.1080/02640410701501689. [DOI] [PubMed] [Google Scholar]
- Gabbay KH, Bohren KM, Morello R, Bertin T, Liu J, Vogel P. Askorbaattisynteesireitti: askorbaatin kaksoisrooli luuston homeostaasissa. The Journal of biological chemistry. 2010;285(25):19510–19520. doi: 10.1074/jbc.M110.110247. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Linster CL, Van Schaftingen E, Vitamin C. Biosynteesi, kierrätys ja hajoaminen nisäkkäissä. The FEBS journal. 2007;274(1):1–22. doi: 10.1111/j.1742-4658.2006.05607.x. [DOI] [PubMed] [Google Scholar]
- Yang H. Säilytetty tai kadotettu: avaingeenin GULO molekulaarinen evoluutio selkärankaisilla C-vitamiinin biosynteesissä. Biochemical genetics. 2013;51(5–6):413–425. doi: 10.1007/s10528-013-9574-0. [DOI] [PubMed] [Google Scholar]
- Nishikimi M, Kawai T, Yagi K. Guinea pigs have a highly mutated gene for L-gulono-gamma-lactone oxidase, the key enzyme for L-ascorbic acid biosynthesis, which is missing in this species. The Journal of biological chemistry. 1992;267(30):21967–21972. [PubMed] [Google Scholar]
- Drouin G, Godin JR, Page B. C-vitamiinin menetyksen genetiikka selkärankaisilla. Current genomics. 2011;12(5):371–378. doi: 10.2174/138920211796429736. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Bates CJ. C-vitamiinin puutos marsuilla: kollageenin vaihteleva herkkyys eri alueilla. Int J Vitam Nutr Res. 1979;49(1):77–86. [PubMed] [Google Scholar]
- Tsuchiya H, Bates CJ. Askorbiinihappopuutoksen vastakkaiset vaikutukset marsuilla: askorbiinihapon vähenemisen ja siihen liittyvän nälkiintymisen vaikutukset kollageeniin ja D-vitamiiniin liittyviin indikaattoreihin. The British journal of nutrition. 1994;72(5):745–752. doi: 10.1079/bjn19940076. [DOI] [PubMed] [Google Scholar]
- Kipp DE, McElvain M, Kimmel DB, Akhter MP, Robinson RG, Lukert BP. Keripukki vähentää kollageenin tuotantoa ja luun tiheyttä marsumallissa. Bone. 1996;18(3):281–288. doi: 10.1016/8756-3282(95)00481-5. [DOI] [PubMed] [Google Scholar]
- Gould B, Schwachman H. Luun ja kudoksen fosfataasi kokeellisessa keripukissa. Am J Phys. 1941;135(2):485–491. [Google Scholar]
- Mohan S, Kapoor A, Singgih A, et al. Hiiren mutantin sfx:n spontaanit murtumat johtuvat gulonolaktonoksidaasigeenin deleetiosta, mikä aiheuttaa C-vitamiinin puutteen. Journal of bone and mineral research. 2005;20(9):1597–1610. doi: 10.1359/JBMR.050406. [DOI] [PubMed] [Google Scholar]
- Jiao Y, Li X, Beamer WG, et al. Deleetio, joka aiheuttaa spontaanin murtuman, tunnistettiin hiiren kromosomi 14:n ehdokasalueelta. Mammalian genome. 2005;16(1):20–31. doi: 10.1007/s00335-004-2414-0. [DOI] [PubMed] [Google Scholar]
- Kawai T, Nishikimi M, Ozawa T, Yagi K. L-gulono-gamma-laktonoksidaasin missense-mutaatio aiheuttaa kyvyttömyyden L-askorbiinihapon synteesiin keripukille alttiilla osteogeneettisilla häiriörotilla. The Journal of biological chemistry. 1992;267(30):21973–21976. [PubMed] [Google Scholar]
- Maeda N, Hagihara H, Nakata Y, Hiller S, Wilder J, Reddick R. Aortan seinämän vaurio hiirillä, jotka eivät pysty syntetisoimaan askorbiinihappoa. Proceedings of the National Academy of Sciences of the United States of America. 2000;97(2):841–846. doi: 10.1073/pnas.97.2.841. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Kim H, Bae S, Yu Y, et al. C-vitamiinin pitoisuuden analyysi gulo(−/−) hiirten elimissä C-vitamiinin poistamisen yhteydessä. Immune network. 2012;12(1):18–26. doi: 10.4110/in.2012.12.1.18. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Kim W, Bae S, Kim H, et al. Askorbiinihapon puute aiheuttaa vakavan luunmuodostuksen vian osteokalsiinituotannon alenemisen kautta. Anatomy & cell biology. 2013;46(4):254–261. doi: 10.5115/acb.2013.46.4.254. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Sakamoto Y, Takano Y. Askorbiinihapon puutoksen morfologiset vaikutukset endokondraalisessa luutumisessa osteogeneettisella häiriörotalla Shionogi. The Anatomical record. 2002;268(2):93–104. doi: 10.1002/ar.10122. [DOI] [PubMed] [Google Scholar]
- Tsunenari T, Fukase M, Fujita T. Luuston histomorfometrinen analyysi osteopenian syystä C-vitamiinin puutteellisella rotalla (ODS-rotta). Calcified tissue international. 1991;48(1):18–27. doi: 10.1007/BF02555792. [DOI] [PubMed] [Google Scholar]
- Beamer WG, Rosen CJ, Bronson RT, et al. Spontaanin murtuman (sfx) hiirimalli, jossa on virheellinen peripuberteettinen luun muodostus. Bone. 2000;27(5):619–626. doi: 10.1016/s8756-3282(00)00369-0. [DOI] [PubMed] [Google Scholar]
- Kondo Y, Inai Y, Sato Y, et al. Ikääntymisen merkkiproteiini 30 toimii gluonolaktonaasina L-askorbiinihapon biosynteesissä, ja sen poistogeeniset hiiret ovat alttiita keripukille. Proceedings of the National Academy of Sciences of the United States of America. 2006;103(15):5723–5728. doi: 10.1073/pnas.0511225103. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Maruyama N, Ishigami A, Kondo Y. Ikääntymisen merkkiproteiini-30:n patologinen merkitys. Geriatrics & gerontology international. 2010;10(Suppl 1):S88–S98. doi: 10.1111/j.1447-0594.2010.00586.x. [DOI] [PubMed] [Google Scholar]
- Park JK, Lee EM, Kim AY, et al. C-vitamiinin puutos nopeuttaa luun menetystä lisäten PPAR-gamman ilmentymistä SMP30 knockout -hiirissä. International journal of experimental pathology. 2012;93(5):332–340. doi: 10.1111/j.1365-2613.2012.00820.x. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Leboy PS, Vaias L, Uschmann B, Golub E, Adams SL, Pacifici M. Askorbiinihappo indusoi emäksistä fosfataasia, tyypin X kollageenia ja kalsiumin kerääntymistä viljellyissä kanan rustosoluissa. The Journal of biological chemistry. 1989;264(29):17281–17286. [PubMed] [Google Scholar]
- Daniel JC, Pauli BU, Kuettner KE. Rustomatriisin synteesi nisäkkäiden rustosoluilla in vitro. III. Askorbiinihapon vaikutukset. The Journal of cell biology. 1984;99(6):1960–1969. doi: 10.1083/jcb.99.6.1960. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Temu TM, Wu KY, Gruppuso PA, Phornphutkul C. ATDC5-kondrogeenisten solujen askorbiinihapon aiheuttaman erilaistumisen mekanismi. American journal of physiology Endocrinology and metabolism. 2010;299(2):E325–E334. doi: 10.1152/ajpendo.00145.2010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Franceschi RT, Iyer BS. Kollageenisynteesin ja MC3T3-E1-soluissa ilmenevän osteoblastifenotyypin välisen suhteen tutkiminen. Journal of bone and mineral research : the official journal of the American Society for Bone and Mineral Research. 1992;7(2):235–246. doi: 10.1002/jbmr.5650070216. [DOI] [PubMed] [Google Scholar]
- Franceschi RT, Young J. Emäksisen fosfataasin säätely 1,25-dihydroksi-D-vitamiinilla ja askorbiinihapolla luuperäisissä soluissa. Journal of bone and mineral research : the official journal of the American Society for Bone and Mineral Research. 1990;5(11):1157–1167. doi: 10.1002/jbmr.5650051111. [DOI] [PubMed] [Google Scholar]
- Xiao G, Cui Y, Ducy P, Karsenty G, Franceschi RT. Askorbiinihappo-riippuvainen osteokalsiinin promoottorin aktivaatio MC3T3-E1 preosteoblasteissa: vaatimus kollageenimatriisin synteesille ja OSE2-sekvenssin eheyden läsnäololle. Molecular endocrinology. 1997;11(8):1103–1113. doi: 10.1210/mend.11.8.9955. [DOI] [PubMed] [Google Scholar]
- Hadzir SN, Ibrahim SN, Abdul Wahab RM, et al. Askorbiinihappo indusoi osteoblastien erilaistumista ihmisen suspensio-mononukleaarisoluista. Cytotherapy. 2014;16(5):674–682. doi: 10.1016/j.jcyt.2013.07.013. [DOI] [PubMed] [Google Scholar]
- Buttery LD, Bourne S, Xynos JD, et al. Osteoblastien erilaistuminen ja luunmuodostus in vitro hiiren alkion kantasoluista. Tissue engineering. 2001;7(1):89–99. doi: 10.1089/107632700300003323. [DOI] [PubMed] [Google Scholar]
- Otsuka E, Yamaguchi A, Hirose S, Hagiwara H. Stromaalisolulinjan ST2 osteoblastiseen erilaistumiseen liittyvä karakterisointi, joka indusoituu askorbiinihapolla. The American journal of physiology. 1999;277(1 Pt 1):C132–C138. doi: 10.1152/ajpcell.1999.277.1.C132. [DOI] [PubMed] [Google Scholar]
- Harada S, Matsumoto T, Ogata E. Askorbiinihapon rooli MC3T3-E1 osteoblastien kaltaisissa soluissa proliferaation säätelyssä. Journal of bone and mineral research : the official journal of the American Society for Bone and Mineral Research. 1991;6(9):903–908. doi: 10.1002/jbmr.5650060902. [DOI] [PubMed] [Google Scholar]
- Takamizawa S, Maehata Y, Imai K, Senoo H, Sato S, Hata R. Askorbiinihapon ja pitkävaikutteisen C-vitamiinijohdannaisen, askorbiinihappo 2-fosfaatin, vaikutukset ihmisen osteoblastin kaltaisten solujen proliferaatioon ja erilaistumiseen. Cell biology international. 2004;28(4):255–265. doi: 10.1016/j.cellbi.2004.01.010. [DOI] [PubMed] [Google Scholar]
- Tsuneto M, Yamazaki H, Yoshino M, Yamada T, Hayashi S. Askorbiinihappo edistää osteoklastogeneesiä alkion kantasoluista. Biochemical and biophysical research communications. 2005;335(4):1239–1246. doi: 10.1016/j.bbrc.2005.08.016. [DOI] [PubMed] [Google Scholar]
- Xiao XH, Liao EY, Zhou HD, Dai RC, Yuan LQ, Wu XP. Askorbiinihappo estää osteoklastogeneesiä RAW264.7 soluissa, jotka indusoituu RANKL:lla in vitro. Journal of endocrinological investigation. 2005;28(3):253–260. doi: 10.1007/BF03345382. [DOI] [PubMed] [Google Scholar]
- Le Nihouannen D, Barralet JE, Fong JE, Komarova SV. Askorbiinihappo nopeuttaa osteoklastien muodostumista ja kuolemaa. Bone. 2010;46(5):1336–1343. doi: 10.1016/j.bone.2009.11.021. [DOI] [PubMed] [Google Scholar]
- Otsuka E, Kato Y, Hirose S, Hagiwara H. Askorbiinihapon rooli osteoklastien muodostumisessa: osteoklastien erilaistumistekijän induktio yhdessä kollageenimatriksin muodostumisen kanssa. Endocrinology. 2000;141(8):3006–3011. doi: 10.1210/endo.141.8.7597. [DOI] [PubMed] [Google Scholar]
- Lean JM, Davies JT, Fuller K, et al. Tioliantioksidanttien keskeinen rooli estrogeenivajauksen aiheuttamassa luukadossa. The Journal of clinical investigation. 2003;112(6):915–923. doi: 10.1172/JCI18859. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Zhu LL, Cao J, Sun M, et al. C-vitamiini estää hypogonadaalista luukatoa. PloS one. 2012;7(10):e47058. doi: 10.1371/journal.pone.0047058. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Padayatty SJ, Katz A, Wang Y, et al. C-vitamiini antioksidanttina: sen roolin arviointi tautien ehkäisyssä. Journal of the American College of nutrition. 2003;22(1):18–35. doi: 10.1080/07315724.2003.10719272. [DOI] [PubMed] [Google Scholar]
- Melhus H, Michaelsson K, Holmberg L, Wolk A, Ljunghall S. Tupakointi, antioksidanttivitamiinit ja lonkkamurtuman riski. Journal of bone and mineral research : the official journal of the American Society for Bone and Mineral Research. 1999;14(1):129–135. doi: 10.1359/jbmr.1999.14.1.129. [DOI] [PubMed] [Google Scholar]
- Baylink DJ, Finkelman RD, Mohan S. Kasvutekijät luun muodostuksen stimuloimiseksi. Journal of bone and mineral research : the official journal of the American Society for Bone and Mineral Research. 1993;8(Suppl 2):S565–S572. doi: 10.1002/jbmr.5650081326. [DOI] [PubMed] [Google Scholar]
- Zunich SM, Valdovinos M, Douglas T, Walterhouse D, Iannaccone P, Lamm ML. Osteoblastien erittämä kollageeni lisää parakriinistä Sonic hedgehog -signaalinvälitystä eturauhassyöpäsoluissa ja edistää osteoblastien erilaistumista. Molecular cancer. 2012;11:30. doi: 10.1186/1476-4598-11-30. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Kim J, Xing W, Wergedal J, Chan JY, Mohan S. Nukleaarisen tekijän erytroidista johdettua 2-kaltaisen 1:n kohdennettu häiriö osteoblasteissa vähentää luun kokoa ja luun muodostumista hiirillä. Physiological genomics. 2010;40(2):100–110. doi: 10.1152/physiolgenomics.00105.2009. [DOI] [PubMed] [Google Scholar]
- Oyake T, Itoh K, Motohashi H, et al. Bach-proteiinit kuuluvat uuteen BTB-perusleusiinivetoketjutyyppisten transkriptiotekijöiden perheeseen, jotka sitoutuvat MafK:hon ja säätelevät transkriptiota NF-E2-sivuston kautta. Molecular and cellular biology. 1996;16(11):6083–6095. doi: 10.1128/mcb.16.11.6083. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Gallorini M, Petzel C, Bolay C, et al. Nrf2:n säätelemän antioksidanttisolureaktion aktivaatio estää HEMA:n aiheuttamaa oksidatiivista stressiä ja tukee solujen elinkykyä. Biomaterials. 2015;56:114–128. doi: 10.1016/j.biomaterials.2015.03.047. [DOI] [PubMed] [Google Scholar]
- Kaspar JW, Niture SK, Jaiswal AK. Nrf2:INrf2 (Keap1) -signalointi oksidatiivisessa stressissä. Free radical biology & medicine. 2009;47(9):1304–1309. doi: 10.1016/j.freeradbiomed.2009.07.035. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Pelin M, De Iudicibus S, Fusco L, et al. Glutationi-S-transferaasin välittämän oksidatiivisen stressin rooli tiopuriinien toksisissa vaikutuksissa. Chemical research in toxicology. 2015;28(6):1186–1195. doi: 10.1021/acs.chemrestox.5b00019. [DOI] [PubMed] [Google Scholar]
- Niture SK, Kaspar JW, Shen J, Jaiswal AK. Nrf2-signalointi ja solujen selviytyminen. Toxicology and applied pharmacology. 2010;244(1):37–42. doi: 10.1016/j.taap.2009.06.009. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Fan L, Li J, Yu Z, Dang X, Wang K. Hypoksi-indusoituvan tekijän polku, prolyylihydroksylaasidomeeni-proteiinin estäjät ja niiden roolit luun korjauksessa ja regeneraatiossa. BioMed research international. 2014;2014:239356. doi: 10.1155/2014/239356. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Xing W, Pourteymoor S, Mohan S. Askorbiinihappo säätelee osterixin ilmentymistä osteoblasteissa aktivoimalla prolyylihydroksylaasin ja ubikitiiniin välittämää proteosomaalisen hajotuksen polkua. Physiological genomics. 2011;43(12):749–757. doi: 10.1152/physiolgenomics.00229.2010. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Minamishima YA, Moslehi J, Bardeesy N, Cullen D, Bronson RT, Kaelin WG., Jr. PHD2-prolyylihydroksylaasin somaattinen inaktivaatio aiheuttaa polysytemiaa ja kongestiivista sydämen vajaatoimintaa. Blood. 2008;111(6):3236–3244. doi: 10.1182/blood-2007-10-117812. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Cheng S, Xing W, Pourteymoor S, Mohan S. Prolyylihydroksylaasidomeeni-proteiini 2:n (Phd2) geenin ehdollinen häiriö paljastaa sen keskeisen roolin luuston kehityksessä. Journal of bone and mineral research. 2014;29(10):2276–2286. doi: 10.1002/jbmr.2258. [DOI] [PubMed] [Google Scholar]
- Wang Y, Wan C, Deng L, et al. Hypoksi-indusoituvan tekijän alfa-polku yhdistää angiogeneesin osteogeneesiin luuston kehityksen aikana. The Journal of clinical investigation. 2007;117(6):1616–1626. doi: 10.1172/JCI31581. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Ding H, Gao YS, Hu C, et al. HIF-1alfa:n transgeeniset luuytimen solut voivat edistää kudoksen korjausta kortikosteroidin aiheuttamassa reisiluun pään osteonekroosissa kaneilla. PloS one. 2013;8(5):e63628. doi: 10.1371/journal.pone.0063628. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Wan C, Gilbert SR, Wang Y, et al. Hypoksi-indusoituvan tekijän 1alfa-polun aktivointi nopeuttaa luun regenerointia. Proceedings of the National Academy of Sciences of the United States of America. 2008;105(2):686–691. doi: 10.1073/pnas.0708474105. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Cheng S, Xing W, Pourteymoor S, Schulte J, Mohan S. Prolyylihydroksylaasidomeeni-proteiini 2 (Phd2) geenin ehdollinen deleetio paljastaa sen keskeisen roolin kondrosyyttien toiminnassa ja endokondraalisessa luutumisessa. Endocrinology. Forthcoming. 2015 doi: 10.1210/en.2015-1473. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Thoms BL, Murphy CL. Hypoksi-indusoituvan tekijän kohdistavan prolyylihydroksylaasidomeeni-proteiini 2:n (PHD2) inhibitio lisää matriisin synteesiä ihmisen kondrosyyteillä. The Journal of biological chemistry. 2010;285(27):20472–20480. doi: 10.1074/jbc.M110.115238. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Riddle RC, Khatri R, Schipani E, Clemens TL. Hypoksi-indusoituvan tekijä 1alfa:n rooli angiogeenis-osteogeenisessä kytkennässä. Journal of molecular medicine. 2009;87(6):583–590. doi: 10.1007/s00109-009-0477-9. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Blaschke K, Ebata KT, Karimi MM, et al. C-vitamiini indusoi Tet-riippuvaista DNA-demetylaatiota ja blastokysti-kaltaisen tilan ES-soluissa. Nature. 2013;500(7461):222–226. doi: 10.1038/nature12362. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Minor EA, Court BL, Young JI, Wang G. Askorbaatti indusoi ten-eleven translocation (Tet) metyylisytosiini-dioxygenaasin välittämää 5-hydroksimetyylisytosiinin muodostumista. The Journal of biological chemistry. 2013;288(19):13669–13674. doi: 10.1074/jbc.C113.464800. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Ponnaluri VK, Maciejewski JP, Mukherji M. Tet-välitteisen 5-metyylisytosiinin oksidaation mekanistinen yleiskatsaus. Biochemical and biophysical research communications. 2013;436(2):115–120. doi: 10.1016/j.bbrc.2013.05.077. [DOI] [PubMed] [Google Scholar]
- Sabsovich I, Clark JD, Liao G, et al. Luun mikrorakenne ja siihen liittyvä geneettinen vaihtelu 12 sisäsiittoisessa hiirikannassa: mikro-CT-tutkimus ja in silico genomin seulonta. Bone. 2008;42(2):439–451. doi: 10.1016/j.bone.2007.09.041. [DOI] [PMC free article] [PubMed] [Google Scholar]
- Pientka FK, Hu J, Schindler SG, et al. Prolyyli-4-hydroksylaasi PHD2:n hapen aistiminen tumakammiossa ja sen vaikutus HIF-1-signalointiin compartmentalisation vaikutuksesta. Journal of cell science. 2012;125(Pt 21):5168–5176. doi: 10.1242/jcs.109041. [DOI] [PubMed] [Google Scholar]
- Mizushima Y, Harauchi T, Yoshizaki T, Makino S. Rotan mutaatio, joka ei kykene syntetisoimaan C-vitamiinia. Experientia. 1984;40(4):359–361. doi: 10.1007/BF01952551. [DOI] [PubMed] [Google Scholar]
- Ishigami A, Fujita T, Handa S, et al. Ikääntymisen merkkiproteiini-30:n knockout-hiiren maksa on erittäin altis tuumorinekroositekijä-alfa- ja Fas-välitteiselle apoptoosille. The American journal of pathology. 2002;161(4):1273–1281. doi: 10.1016/s0002-9440(10)64404-5. [DOI] [PMC free article] [PubMed] [Google Scholar]